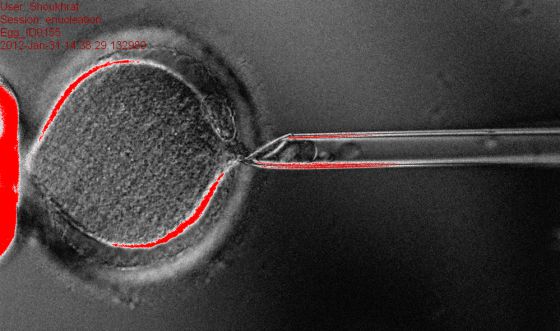
Un grupo de científicos estadounidenses ha conseguido por primera vez células madre embrionarias con el mismo ADN (clonadas) de un adulto. El trabajo es el primer éxito en humanos de la técnica que dio origen, por ejemplo, a la oveja Dolly, pero los autores insisten en que no se trata de obtener personas clonadas, sino en llegar a la fase de blastocisto del embrión (alrededor de los cinco o seis días de desarrollo) para extraer las células madre. Teóricamente, estas podrían luego diferenciarse en tejidos que el paciente necesitara para un autotrasplante, que, como tendrían el mismo material genético que el receptor, podría usarse sin riesgo de rechazo. El ensayo, dirigido por Shoukhrat Mitalipov, de la prestigiosa OHSU (Oregon Health & Science University ), se publica en Cell. pulsa en la foto La técnica utilizada es la de transferencia nuclear:: se toma un óvulo de una donante, se le extrae el núcleo y se le inserta una célula adulta —también se ha ensayado con otras fetales, más adaptables— del posible receptor. Luego, el óvulo se activa, y empieza a dividirse en los primeros pasos del desarrollo embrionario. Al llegar a la fase de blastocisto (una especie de pelota de células), se destruye y se obtienen las células madre. Esto sucede porque al cambiar el material genético el óvulo deja de tener una sola cadena de ADN para tener dos, lo normal en las células. Esta es la situación que se da en la naturaleza cuando hay una fecundación (el padre aporta una copia del material genético y la madre otra), salvo que estas células tendrían las dos copias de un mismo individuo: son, por eso, una clonación. El método ya se había ensayado con éxito en distintos animales —ovejas, cabras, vacas, perros, gatos, ratones, cerdos y macacos—, pero nunca había funcionado en personas. Fue el fraude que anunció para apuntarse el éxito el coreano Hwang Woo-suk en 2004, por ejemplo. Por eso, Anna Veiga, directora del banco de líneas celulares del Centro de Medicina Regenerativa de Barcelona (CMRB), valora especialmente que se ha conseguido mejorar la técnica para que funcione en humanos. Pero esta mejoría, con todo su impacto, no oculta que se acerca, al menos un paso, a un tema tabú (en España, por ejemplo, está expresamente prohibido por la ley de reproducción humana asistida): la clonación humana. Visto hasta aquí, el artículo es muy importante, y tanto a Veiga como a Jorge Cuadros, miembro de la junta directiva de la Asociación para el Estudio de la Biología de la Reproducción (Asebir), les gustaría que el interés por el trabajo se quedara aquí. “Ya es bastante importante”, dice Cuadros. “Lo que nos interesa a los científicos serios es esta parte, su utilidad para la medicina regenerativa”. Pero ambos son conscientes, como también lo son los autores del artículo, de que se ha dado, al menos en teoría, un paso hacia la clonación humana. El propio Mitalipov lo alude —y lo intenta conjugar— en el resumen que ha hecho en una nota de prensa: “Nuestra investigación está directamente dirigida a conseguir células madre para usarlas en el futuro para combatir enfermedades. Aunque los avances en la técnica de transferencia nuclear conducen a menudo a la discusión pública sobre los aspectos éticos de la clonación humana, ese no es nuestro objetivo. Y tampoco creemos que nuestros hallazgos puedan ser utilizados por otros para avanzar en esa dirección”, ha dicho. más información Cuadros, está en la misma línea de descartar ese siguiente paso, que un embrión así producido se implante en el útero de una mujer y llegue a desarrollarse. “Hay que pensar que la técnica que ha usado Mitalipov es la misma que había utilizado en primates no humanos en 2007, cuando consiguió, en un trabajo importantísimo, crear dos líneas celulares [cultivos de células madre que se perpetúan en laboratorio]”, explica. “Han pasado ni más ni menos que seis años hasta que lo ha conseguido repetir en humanos. Y, en ese tiempo, ha intentado clonar los macacos sin conseguirlo”, dice el biólogo. “Lo más que ha conseguido, aunque no lo ha publicado, es, tras implantar 67 embriones a 10 hembras, un embarazo, que acabó en aborto”, cuenta. El especialista en reproducción cree, por tanto, que pensar en la clonación humana “sigue siendo una barbaridad y ciencia ficción”. “La transferencia nuclear es una técnica insegura e ineficaz. La hemos probado en animales, con tasas de éxito del 1%. Eso quiere decir que en el otro 99% ha habido abortos o crías que han muerto nada más nacer, y muchos de los pocos animales que se han conseguido tienen malformaciones o enfermedades graves. Que eso pase en animales nos da pena, pero en humanos sería inaceptable”, dice Cuadros. “En lo que va a ser útil es en la medicina regenerativa”, insiste. Solo tras insistirle, el especialista admite que se ha dado “un paso” hacia la clonación reproductiva (usar la técnica para conseguir niños con el mismo ADN que un adulto concreto, y, por lo tanto, lo más parecidos, al menos físicamente, que se puede ser). “Pero es solo eso, un paso, y faltarían muchos por cubrir”. Los expertos creen que es un paso, pero que falta mucho para crear humanos idénticos El motivo está en que, hasta ahora, la técnica no es demasiado eficaz. “Que se haya llegado a la fase de blastocisto no implica que ese embrión vaya a seguir desarrollándose si se implanta en un útero de una mujer o que lo haga sin abortar o sin anomalías. Hay reparos éticos y técnicos para ello. Los primeros no han cambiado, y los segundos todavía pesan aún más”. Yendo aún más allá, Cuadros no cree que “científicos serios” quieran nunca dar ese paso. “Cuando se clonó a la oveja Dolly, hace 15 años, yo enseñaba en la universidad que eso no era posible, que era demasiado complejo, y tuve que cambiar. Llevamos desde entonces hablando de clonar personas, pero hay una pregunta que me hice entonces y que nadie me ha contestado: ¿para qué hacerlo? Los científicos serios ni se lo plantean, porque es algo que no tiene ninguna utilidad. Si alguien quiere tener un hijo y no puede, hay otros métodos mucho más sencillos y con menos riesgos. Por eso lo importante de este trabajo, que ya he dicho que es un hito, es lo que ha conseguido”. La complicación de usar la técnica de Dolly en personas ha sido hasta ahora insalvable, y por eso el estudio tiene el mérito de que la vence. Las mejoras abarcan casi todo el proceso, empezando por el proceso de estimulación para que la donante produzca más óvulos. “Cuestiona los protocolos actuales”, dice Veiga. En contra de lo que se pensaba, por ejemplo, el objetivo no es que haya muchos óvulos para utilizar, sino su calidad. En animales esta parte no se cuida tanto, ya que perder óvulos por el camino no es tan importante, pero los investigadores han llegado, en algunos casos, a tener éxitos del 50% (conseguir dos óvulos de una donante y que uno de ellos funcione y se desarrolle). Pero la clave, según los autores, está en su capacidad para elegir el momento de insertar el nuevo material genético en el óvulo sin que este pierda su capacidad para dividirse. La división celular se denomina meiosis, y los investigadores han descubierto cuál de sus fases es la mejor y, sobre todo, cómo mantener la activación de los factores del citoplasma (el contenido interior de la célula) que están actuando en la división. Hay más mejoras, indica Veiga, como que la activación posterior se refuerza mediante electroporación (una pequeña descarga). Todo esto había sido ya probado en macacos rhesus. El artículo —“impecable”, según Veiga— llega hasta el final del proceso: la obtención de cuatro líneas celulares diferenciadas, lo que demuestra que se consiguieron células madre. En este sentido, el de la medicina regenerativa, “el trabajo es un hito”, afirma Cuadros. La investigadora catalana recalca que las células así obtenidas, al ser completamente equiparables a las embrionarias, evitan algunos de los problemas que se han visto en la otra fuente de células madre, las reprogramadas a partir de las adultas (las iPS, que en algunos trabajos han demostrado que mantenían algunas mutaciones adquiridas por las adultas que son su fuente, lo que podía ser peligroso). Por eso ella insiste en que el trabajo tendrá gran importancia a la hora de crear bancos para su uso futuro, similares a los que hay ahora de cordón umbilical. Porque, aunque los autores lo mencionen, la idea de hacer una medicina personalizada en la que cuando un paciente necesite tejido cardiaco o neuronas, por ejemplo, se le someta a todo el proceso para fabricar unas genéticamente idénticas a él, no le parece “contemplable”. “Aunque sea posible sería carísimo. Lo que se pueden tener son bancos con variedad de muestras que sean compatibles”, añade. El logro es indudable, pero quizá quede oscurecido por la posibilidad de la clonación, mucho menos práctica pero más llamativa.






![A diferencia de todos los demás organismos conocidos, la bacteria Borrelia burgdorferi necesita manganeso, representado con puntos azules en el esquema, en vez de hierro. (Ilustración: P. John Hart, Universidad de Texas) [Img #13065]](http://noticiasdelaciencia.com/upload/img/periodico/img_13065.jpg)











